翻訳後修飾つくってワクワク!ベンジル化リジン修飾-認識のタンパク質セットの設計 #今年読んだ一番好きな論文2020
*この記事は今年読んだ一番好きな論文Advent calender2020の12/20の記事です。
2021/12/20 改定
こんにちは、南の島で大学院生をしているしまふくろう (@is1andowl)と申します。
この企画を機にはてブを開設しました。いつも論文紹介ツールを悩んでしまうので、これからはこのブログを使って行こうと思います。
さて、今回紹介する論文はこちらです。
Arora, S., Horne, W. S. & Islam, K. Engineering Methyllysine Writers and Readers for Allele-Specific Regulation of Protein-Protein Interactions. J. Am. Chem. Soc. 141, 15466–15470 (2019). https://doi.org/10.1021/jacs.9b05725
PMCで全文読めます. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6988089/
一文まとめ
リジンベンジル化酵素とその修飾認識タンパク質のセットをBump-and-hole法で設計した。
前提となる予備知識
DNAからRNAに情報が読み取られたのち(転写)、RNA上の情報をもとにタンパク質が作られます(翻訳)。ここで作られたタンパク質がそのまま機能を発揮できるわけではなく、さらにパーツをつけることで本来の機能を発揮する(あるいは抑制される)ことがあります。このパーツのことを翻訳後修飾と呼びます。
この翻訳後修飾を作り出すものをライター (writer)、認識するものをリーダー (reader)、消去するものをイレイサー(eraser. 今回は登場しません)とそれぞれ呼びます。
今回紹介する論文は、アミノ酸のリジンをメチル化するメチル化酵素(ライタータンパク質)と、その認識タンパク質(リーダータンパク質)の改変に関する研究です。
ヒトにおいて、約60種類のリジンメチル化酵素 (KMT) と200種類以上のリジンメチル化認識ドメインを持つタンパク質によって、5000箇所以上のメチル化リジンサイトの構築と認識に寄与しているといわれています。しかし、どのメチル化リジンがどのような細胞内ネットワーク制御に重要であるかはまだ十分に明らかにされていません。
この論文では、メチル化の代わりに自然界に存在しない修飾を導入できるライタータンパク質を設計し、その修飾だけを認識できるリーダータンパク質をセットとして設計できれば、他のシステムに影響を及ぼすことなくと考えました (Figure 1)。メチル化酵素はS-アデノシルメチオニン(SAM)と呼ばれる補酵素からメチル基を転移させるのですが、このメチル基の部分を他の化学修飾に変えることで、メチル化以外の修飾を導入することができます。
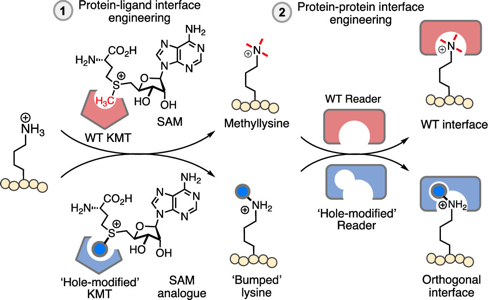
Figure 1. Bump-and-holeシステムによるメチル化酵素/メチル化認識酵素の改変
J. AM. CHEM. SOC. 2019, 141, 39, 15466–15470. COPYRIGHT © 2019, AMERICAN CHEMICAL SOCIETY
では、どのようにタンパク質の機能を改変するのでしょうか?タンパク質の機能改変のアプローチをざっくりと分けると、(1) 立体構造や機能ベースの合理的改変、(2) 進化分子工学などランダム変異による機能改変、(3)計算機を駆使したタンパク質デザインの3種類に区分できます。
この論文では、(1)の中でもBump-and-hole法(凹凸法)*1という戦略で機能改変を行いました。
Bump-and-hole法(凹凸法)とは?
bump-and-hole法は,ある特定のリガンド (bump)を認識するために、変異によってタンパク質側にそれが入るための空間 (hole)を作ることで、タンパク質とリガンドの直交した対を作製する方法です。と書いてもピンとこないのでFigure 2をご覧ください。

本論文の筆者らは、まずライタータンパク質とその補酵素(酵素の機能に必要な分子)の改変を行い(タンパク質-リガンド相互作用部位)、非天然の修飾を持つペプチドとリーダータンパク質の改変(タンパク質-タンパク質相互作用部位)を行いました (Figure 2)。
前置きが長くなりましたが、結果の方に移っていきましょう。
ライター / リーダータンパク質の改変
このグループが改変を試みたのは、メチル化酵素G9a (ライター)とメチル化認識タンパク質CBX1(リーダー)の組み合わせです。G9aはヒストン3*2というタンパク質の9番目のアミノ酸のリジンをトリメチル化します。以後この修飾をH3K9me3と書きます。
このグループは過去にメチル化酵素G9aの変異体(Y1154A)を作製し、蛍光色素TAMRAをH3K9に導入することに成功していました。筆者らはこの変異体のタンパク質内の空間をさらに拡張(Y1154G)し、SAMの代わりにベンジル化S-アデノシルメチオニン(SAM-bn)を補酵素として使用できるように改変しました。こうしてメチル化の代わりにベンジル化を触媒する酵素の設計に成功したのです。以後このベンジル化タンパク質(あるいはペプチド)上の非天然修飾をH3K9bnと書きます。
次に、メチル化認識タンパク質CBX1の基質認識に関わるアミノ酸を置換し、本来の基質であるトリメチル化されたH3K9me3を認識せず、H3K9bnを認識できる変異を探索したました。その結果、CBX1のY26F/F50G変異体はH3K9me3 (Kd = ∼80 μM)よりもH3K9bn (Kd = 5.5 ± 0.9 μM)に高い選択性を示しました (約14倍の選択性)。選択性が決していいわけではないのですが、一応H3K9bnを選択的に認識するリーダータンパク質の設計に成功しました。このCBX1 Y26F/F50G変異体とH3K9bnの共結晶構造解析から、タンパク質内のポケットが大きくなったことでベンジル基を認識することができたということがわかりました (Figure 3)。bump-and-hole法がうまく機能したわけです。
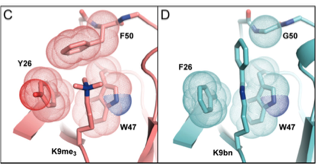
J. AM. CHEM. SOC. 2019, 141, 39, 15466–15470. COPYRIGHT © 2019, AMERICAN CHEMICAL SOCIETY
なお、今回変異を加えたG9aの1154番目のチロシン残基とCBX1の50番目のフェニルアラニン残基は、他のメチル化酵素あるいはメチル化認識タンパク質で保存されていました。そこで他のタンパク質に同様の部位に変異を加えることで、ベンジル化反応する改変メチル化酵素やH3K9bnペプチド認識タンパク質の作製に成功しました。試している数は少ないですが、認識部位の配列(や立体構造)が似ていれば、bump-and-hole法が他のタンパク質にも適用できうることの好例になっています。
改変CBX1と細胞内タンパク質の相互作用
改変CBX1タンパク質単体ではH3K9bnペプチドに対する選択的な結合が見られましたが、他の因子が含まれる細胞抽出液でも機能するのでしょうか? 筆者らは、ヒト胎児腎細胞HEK293Tに発現させたHAタグ付き-CBX1 Y26F/F50G変異体が、in vitroでベンジル化リジンペプチドを選択的に認識できるかをテストしました。このタンパク質が含まれている細胞の核画分を抽出し、トリメチル化あるいはベンジル化ペプチドと結合したタンパク質を回収しました (より詳細に書くと、biotin化ペプチドを用いたbiotin-avidinのプルダウンをしています)。その結果、改変型CBX1はH3K9me3ペプチドやその他のトリメチル化ペプチドとの結合はほとんど確認できませんでしたが(Figure 4B, C)、H3K9bnペプチドでプルダウンしたときにはHAタグ由来のバンドが確認されました(Figure 4B)。このことから、改変CBX1は細胞抽出液においてもH3K9bnを認識していると示唆されました。
最後に、今回作成されたCBX1タンパク質が果たしてメチル化ネットワークを解析する有用なツールとして利用できるのかを検証しています。CBX1タンパク質は転写制御因子のTIF1βと相互作用することがすでに知られていました。そこで、H3K9bnペプチドと結合した改変CBX1を回収したときに、TIF1βも一緒に発見されるかを調べたところ、仮説通りCBX1-H3K9bnの組み合わせでTIF1βを検出することができました (Figure 4D)。
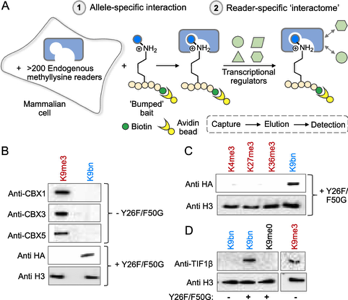
Figure 4. CBX1 Y26F/F50G変異体を発現する細胞抽出液での実験
A. 実験系の説明. 核画分から抽出したタンパク質を修飾ペプチドと混ぜ、結合したタンパク質のみを精製した。B. 細胞内に元々存在するCBXタンパク質はH3K9me3ペプチドに選択的に結合し、改変CBX1はH3K9bnペプチドにだけ結合した. C. 改変CBX1は他のトリメチル化ペプチドとは相互作用をほとんどしなかった。D. 改変CBX1は野生型CBX1の結合相手であるTIFβとも相互作用した。
J. AM. CHEM. SOC. 2019, 141, 39, 15466–15470. COPYRIGHT © 2019, AMERICAN CHEMICAL SOCIETY
感想
「人工翻訳後修飾の修飾/認識セットを作り、それで制御されるシステムを作りたい」というのが研究における大きな興味の一つで、まさにやってみたい研究をしている論文でした。bump-and-hole法で酵素ポケットを広げて人工補酵素や基質を認識させることや、人工リガンドを認識するタンパク質を設計する研究はいろいろある印象ですが、翻訳後修飾酵素-認識タンパク質のセットを作ったところが個人的推しポイントです。
今後大きなチャレンジがあるとすれば、細胞内での修飾/認識ができる系が作れるかだと思っています。安定的に人工補酵素(ここではSAM誘導体)を細胞内に供給するのは簡単ではなく、本論文でもあくまで細胞外に取り出してきて反応あるいは修飾認識の実験しか行えていません。細胞内での修飾/認識のシステムが作れると(個人的には)より面白い展開になると感じています。
以上、#今年読んだ一番好きな論文2020, 12/20の記事でした!
少しでも面白いと思っていただけたのであれば幸いです。紹介にあたって結構端折った部分も多いので、興味ある方はぜひ本文も目を通して見てください!
(修正) 2020/12/21 13:14 Figure 2が間違っていたので修正しました。
*1:bump-and-hole法は本論文ではAllele-specific chemical geneticsと呼んでいるのですが、bump-and-holeの方がメジャーな呼び方だと思います。この手法の原典に興味がある方はこちらNature, 407, 395–401(2000)をどうぞ
*2:ヒストンタンパク質はdocr16sさんもこのアドベントカレンダーで取り上げてて、ネタが被ってしまったな...